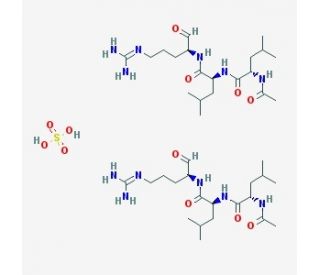
Leupeptin hemisulfate (CAS 103476-89-7)
Vedere citazioni di prodotto (19)
LINK RAPIDI
L'emisolfato di leupeptina è un inibitore reversibile e competitivo delle proteasi che ha dimostrato di inibire le catepsine B, H, L e S, la calpaina e la tripsina. È anche un inibitore reversibile delle proteasi cisteina, serina e treonina prodotte naturalmente dagli Streptomyces. L'emisolfato di leupeptina non ha effetto su chimotripsina, elastasi, renina e pepsina. Nella ricerca biochimica, viene utilizzata spesso come agente riducente negli esperimenti per lo studio di proteine, enzimi, aminoacidi e neuropeptidi. L'emisolfato di leupeptina può essere utilizzato anche come strumento di purificazione delle proteine per evitare che le proteasi presenti nei campioni di tessuto degradino la proteina di interesse. In generale, i ricercatori la utilizzano per studiare gli effetti dell'inibizione delle proteasi sul metabolismo cellulare, sull'attività enzimatica, sull'espressione genica, sulla sintesi proteica, sulla degradazione e sul ripiegamento delle proteine.
Leupeptin hemisulfate (CAS 103476-89-7) Referenze
- Caratterizzazione dei complessi intracellulari di trascrizione inversa del virus dell'immunodeficienza umana di tipo 1. | Fassati, A. and Goff, SP. 2001. J Virol. 75: 3626-35. PMID: 11264352
- Analisi della sequenza, distribuzione tissutale ed espressione della catepsina S di ratto. | Petanceska, S. and Devi, L. 1992. J Biol Chem. 267: 26038-43. PMID: 1281481
- La fosforilazione della chinasi p70s6 è implicata nell'anabolismo del muscolo levatore ani indotto dagli androgeni nei ratti castrati. | Xu, T., et al. 2004. J Steroid Biochem Mol Biol. 92: 447-54. PMID: 15698549
- Microtubuli in cellule mesofile di spinaci non acclimatati e acclimatati al freddo: visualizzazione e risposte al congelamento, alle basse temperature e alla disidratazione. | Bartolo, ME. and Carter, JV. 1991. Plant Physiol. 97: 175-81. PMID: 16668366
- Inibitori della catepsina B. | Frlan, R. and Gobec, S. 2006. Curr Med Chem. 13: 2309-27. PMID: 16918357
- Caratterizzazione dei promotori vascolari RSs1 e rolC per il loro utilizzo nell'ingegneria delle piante per lo sviluppo di resistenza contro gli insetti emitteri. | Saha, P., et al. 2007. Planta. 226: 429-42. PMID: 17323077
- Analisi dei limiti dell'espressione dell'antigene di superficie dell'epatite B in colture di sospensione di cellule di soia. | Ganapathi, TR., et al. 2007. Plant Cell Rep. 26: 1575-84. PMID: 17534624
- Isolamento di anelli citochinici di actomiosina da Saccharomyces cerevisiae e Schizosaccharomyces pombe. | Huang, J., et al. 2016. Methods Mol Biol. 1369: 125-136. PMID: 26519310
- Inibizione delle attività proteolitiche delle cellule vegetali che degradano la tubulina. | Morejohn, LC., et al. 1985. Cell Biol Int Rep. 9: 849-57. PMID: 2864138
- Preparazione di vescicole rivestite di clatrina da piantine di Arabidopsis thaliana. | Mosesso, N., et al. 2018. Front Plant Sci. 9: 1972. PMID: 30687367
- Leupeptine, nuovi inibitori di proteasi da Actinomiceti. | Aoyagi, T., et al. 1969. J Antibiot (Tokyo). 22: 283-6. PMID: 5810993
- Polimerizzazione dei microtubuli in rosa indotta dal taxolo in vitro e sua inibizione da parte della colchicina. | Morejohn, LC. and Fosket, DE. 1984. J Cell Biol. 99: 141-7. PMID: 6145718
- Catepsina B, Catepsina H e Catepsina L. | Barrett, AJ. and Kirschke, H. 1981. Methods Enzymol. 80 Pt C: 535-61. PMID: 7043200
- Catepsina B umana. Applicazione del substrato N-benzilossicarbonil-L-arginil-L-arginina 2-naftilamide allo studio dell'inibizione da parte della leupeptina. | Knight, CG. 1980. Biochem J. 189: 447-53. PMID: 7213339
Informazioni ordini
| Nome del prodotto | Codice del prodotto | UNITÀ | Prezzo | Quantità | Preferiti | |
Leupeptin hemisulfate, 5 mg | sc-295358 | 5 mg | RMB824.00 | |||
Leupeptin hemisulfate, 10 mg | sc-295358C | 10 mg | RMB1139.00 | |||
Leupeptin hemisulfate, 25 mg | sc-295358A | 25 mg | RMB1670.00 | |||
Leupeptin hemisulfate, 50 mg | sc-295358D | 50 mg | RMB3565.00 | |||
Leupeptin hemisulfate, 100 mg | sc-295358E | 100 mg | RMB5630.00 | |||
Leupeptin hemisulfate, 500 mg | sc-295358B | 500 mg | RMB16099.00 |
