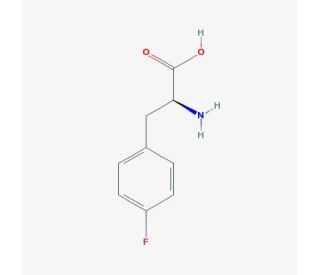
L-4-Fluoro-phenyl-alanine (CAS 1132-68-9)
Direktverknüpfungen
L-4-Fluoro-Phenyl-Alanin ist ein Derivat der essentiellen Aminosäure Phenylalanin. Dieser synthetische Verbindung ähnelt dem natürlich vorkommenden L-Phenylalanin (L-Phe) sehr, unterscheidet sich aber nur durch die Substitution eines Wasserstoffatoms mit einem Fluoratom. Die einzigartigen Eigenschaften von L-4-Fluoro-Phenyl-Alanin haben die Erforschung in vitro Studien angeregt. In vitro Studien haben sich darauf konzentriert, L-4-Fluoro-Phenyl-Alanin als Substrat für Enzyme zu nutzen, die an der Protein-Synthese beteiligt sind. Obwohl der genaue Wirkmechanismus von L-4-Fluoro-Phenyl-Alanin noch nicht vollständig verstanden ist, wird angenommen, dass es die Bioverfügbarkeit bestimmter Arzneimittel verbessert und als Substrat für bestimmte Enzyme dient, die an der Protein-Synthese und der Arzneimittel-Metabolisierung beteiligt sind.
L-4-Fluoro-phenyl-alanine (CAS 1132-68-9) Literaturhinweise
- Fluoreszenz- und 19F-NMR-Nachweise, dass Phenylalanin, 3-L-Fluorphenylalanin und 4-L-Fluorphenylalanin an den L-Leucin-spezifischen Rezeptor von Escherichia coli binden. | Luck, LA. and Johnson, C. 2000. Protein Sci. 9: 2573-6. PMID: 11206079
- Phenylalanin-Dehydrogenase-Mutanten: effiziente Biokatalysatoren für die Synthese von nicht natürlichen Phenylalanin-Derivaten. | Paradisi, F., et al. 2007. J Biotechnol. 128: 408-11. PMID: 16996633
- Doppelte Wirkung von [Tyr(6)]-gamma2-MSH(6-12) auf die Schmerzwahrnehmung und die hyperalgetische Wirkung seiner Analoga in vivo. | Wei, C., et al. 2010. J Pept Sci. 16: 451-5. PMID: 20629198
- Antimikrobielle Peptide und ihre überlegenen fluorierten Analoga: Struktur-Wirkungs-Beziehungen durch NMR-Spektroskopie und MD-Berechnungen. | Díaz, MD., et al. 2010. Chembiochem. 11: 2424-32. PMID: 21077089
- Konformation des Gramicidin-A-Kanals in Phospholipidvesikeln: eine Fluor-19-Kernspinresonanzstudie. | Weinstein, S., et al. 1985. Biochemistry. 24: 4374-82. PMID: 2413886
- Fluorierte Aminosäuren: eine Rarität in der Natur, aber eine Chance für das Protein-Engineering. | Odar, C., et al. 2015. Biotechnol J. 10: 427-46. PMID: 25728393
- Lösungsmittelzugänglichkeit diskreter Restpositionen im Polypeptidhormon Glucagon durch 19F-NMR-Beobachtung von 4-Fluorphenylalanin. | Hou, Y., et al. 2017. J Biomol NMR. 68: 1-6. PMID: 28508109
- Antivirale Aktivität von peptidbasierten Zusammensetzungen. | Hu, T., et al. 2021. ACS Appl Mater Interfaces. 13: 48469-48477. PMID: 34623127
- Synthese von 2,6-Dimethyltyrosin-ähnlichen Aminosäuren durch Pinacolinamid-gestützte C-H-Dimethylierung von 4-Dibenzylamino-Phenylalanin. | Illuminati, D., et al. 2022. J Org Chem. 87: 2580-2589. PMID: 35138099
- Die Überexpression des A4-rolB-Gens aus dem pRiA4 von Rhizobium rhizogenes moduliert die Hormonhomöostase und führt zu einer erhöhten Flavonoidakkumulation und Trockentoleranz in transgenen Pflanzen von Arabidopsis thaliana. | Veremeichik, GN., et al. 2022. Planta. 256: 8. PMID: 35690636
- Die Chromosomenkondensationsfähigkeit mitotischer Proteine wird durch die Substitution von Phenylalanin durch Parafluorphenylalanin vermindert. | Sunkara, PS., et al. 1981. Eur J Cell Biol. 23: 312-6. PMID: 7193581
- Regulation der Phenylalanin-Hydroxylase in der Rattenleber. I. Kinetische Eigenschaften der Eisen- und Enzymreduktionsstelle des Enzyms. | Shiman, R., et al. 1994. J Biol Chem. 269: 24637-46. PMID: 7929135
- Ein Mechanismus für die Hydroxylierung durch Tyrosin-Hydroxylase, der auf der Aufteilung von substituierten Phenylalaninen beruht. | Hillas, PJ. and Fitzpatrick, PF. 1996. Biochemistry. 35: 6969-75. PMID: 8679520
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
L-4-Fluoro-phenyl-alanine, 100 mg | sc-207785 | 100 mg | CNY542.00 | |||
L-4-Fluoro-phenyl-alanine, 1 g | sc-207785A | 1 g | CNY1986.00 |
