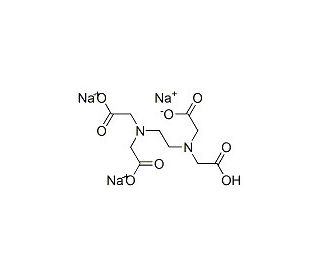
EDTA, 0.5 M, pH 8.0 (CAS 60-00-4)
Produktreferenzen ansehen (7)
Direktverknüpfungen
Ethylendiamintetraessigsäure (EDTA) ist eine vielseitige chemische Verbindung, die aufgrund ihrer außergewöhnlichen chelatbildenden Eigenschaften in der wissenschaftlichen Forschung häufig eingesetzt wird. In Labors wird sie üblicherweise als 0,5-M-Lösung mit einem pH-Wert von 8,0 hergestellt. In der Forschung wird EDTA hauptsächlich als Chelatbildner eingesetzt, d. h. es bildet stabile Komplexe mit Metallionen. Diese Eigenschaft macht es für verschiedene biochemische und molekularbiologische Anwendungen von unschätzbarem Wert. So wird EDTA in der Molekularbiologie häufig eingesetzt, um zweiwertige Kationen wie Magnesium (Mg^2+) zu chelatisieren, die für Nukleinsäurepolymerasen unerlässlich sind. Indem es diese Ionen sequestriert, hemmt EDTA die Enzymaktivität, so dass die Forscher Nukleinsäuren ohne unerwünschte enzymatische Reaktionen manipulieren und untersuchen können. Darüber hinaus wird EDTA häufig in der analytischen Chemie eingesetzt, insbesondere beim Nachweis von Metallionen und bei Titrationen. Seine Fähigkeit, selektiv an bestimmte Metallionen zu binden, ermöglicht die präzise Bestimmung und Quantifizierung von Metallen in komplexen Gemischen. Neben seiner Rolle als Chelatbildner dient EDTA als Stabilisierungsmittel in verschiedenen Laborreagenzien und -lösungen. Seine Fähigkeit, metallionenvermittelte Katalyse oder Zersetzung zu verhindern, erhöht die Stabilität und Haltbarkeit vieler biochemischer und molekularbiologischer Reagenzien.
EDTA, 0.5 M, pH 8.0 (CAS 60-00-4) Literaturhinweise
- Abschlussbericht über die Sicherheitsbewertung von EDTA, Calcium-Dinatrium-EDTA, Diammonium-EDTA, Dikalium-EDTA, Dinatrium-EDTA, TEA-EDTA, Tetranatrium-EDTA, Trikalium-EDTA, Trinatrium-EDTA, HEDTA und Trinatrium-HEDTA. | Lanigan, RS. and Yamarik, TA. 2002. Int J Toxicol. 21 Suppl 2: 95-142. PMID: 12396676
- Einige weitere Beobachtungen über die Wechselwirkung von EDTA mit dem Myosin-ATP-System. | FRIESS, EG., et al. 1954. Arch Biochem Biophys. 53: 311-3. PMID: 13208306
- Bismut-EDTA-Komplex. | SAPEIKA, N. 1955. S Afr Med J. 29: 137-9. PMID: 14358876
- Die Hemmung der hämatopoetischen Wirkung von Kobalt durch Ethylendiamin. tetraessigsäure (EDTA). | CHILD, GP. 1951. Science. 114: 466-7. PMID: 14892768
- RNase-Footprinting zur Kartierung von RNA-Protein-Interaktionen. | Nilsen, TW. 2014. Cold Spring Harb Protoc. 2014: 677-82. PMID: 24890210
- Die Nekroptose vermittelt die antineoplastischen Wirkungen der löslichen Fraktion des Polysaccharids aus Rotwein bei Ratten, die einen Walker-256-Tumor tragen. | Stipp, MC., et al. 2017. Carbohydr Polym. 160: 123-133. PMID: 28115086
- Stabile Chelatverbindung für die reversible Immobilisierung von mit Oligohistidin markierten Proteinen im BIAcore-Oberflächenplasmonenresonanzdetektor. | Gershon, PD. and Khilko, S. 1995. J Immunol Methods. 183: 65-76. PMID: 7602140
- Bestimmung von EDTA im Blut. | Sheppard, RL. and Henion, J. 1997. Anal Chem. 69: 477A-480A. PMID: 9253241
Bestellinformation
| Produkt | Katalog # | EINHEIT | Preis | ANZAHL | Favoriten | |
EDTA, 0.5 M, pH 8.0, 100 ml | sc-203932 | 100 ml | CNY226.00 |
