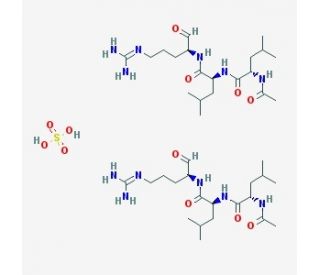
Leupeptin hemisulfate (CAS 103476-89-7)
Voir les citations produits (19)
ACCÈS RAPIDE AUX LIENS
L'hémisulfate de leupeptine est un inhibiteur de protéase compétitif et réversible qui s'est révélé capable d'inhiber les cathepsines B, H, L et S, la calpaïne et la trypsine. Il s'agit également d'un inhibiteur réversible des protéases à cystéine, sérine et thréonine produites naturellement par Streptomyces. L'hémisulfate de leupeptine n'a aucun effet sur la chymotrypsine, l'élastase, la rénine ou la pepsine. En recherche biochimique, il est fréquemment utilisé comme agent réducteur dans les expériences visant à étudier les protéines, les enzymes, les acides aminés et les neuropeptides. L'hémisulfate de leupeptine peut également être utilisé comme outil de purification des protéines pour empêcher les protéases présentes dans les échantillons de tissus de dégrader la protéine en question. Globalement, les chercheurs l'utilisent pour étudier les effets de l'inhibition des protéases sur le métabolisme cellulaire, l'activité enzymatique, l'expression des gènes, la synthèse des protéines, la dégradation des protéines et le repliement des protéines.
Leupeptin hemisulfate (CAS 103476-89-7) Références
- Caractérisation des complexes intracellulaires de transcription inverse du virus de l'immunodéficience humaine de type 1. | Fassati, A. and Goff, SP. 2001. J Virol. 75: 3626-35. PMID: 11264352
- Analyse de la séquence, distribution tissulaire et expression de la cathepsine S de rat. | Petanceska, S. and Devi, L. 1992. J Biol Chem. 267: 26038-43. PMID: 1281481
- La phosphorylation de la kinase p70s6 est impliquée dans l'anabolisme musculaire du levator ani induit par les androgènes chez les rats castrés. | Xu, T., et al. 2004. J Steroid Biochem Mol Biol. 92: 447-54. PMID: 15698549
- Microtubules dans les cellules mésophylles d'épinards non acclimatés et acclimatés au froid: visualisation et réponses à la congélation, aux basses températures et à la déshydratation. | Bartolo, ME. and Carter, JV. 1991. Plant Physiol. 97: 175-81. PMID: 16668366
- Inhibiteurs de la cathepsine B. | Frlan, R. and Gobec, S. 2006. Curr Med Chem. 13: 2309-27. PMID: 16918357
- Caractérisation des promoteurs RSs1 et rolC spécifiques au système vasculaire en vue de leur utilisation dans l'ingénierie des plantes pour développer une résistance contre les insectes nuisibles hémiptères. | Saha, P., et al. 2007. Planta. 226: 429-42. PMID: 17323077
- Analyse des limites de l'expression de l'antigène de surface de l'hépatite B dans les cultures de suspension de cellules de soja. | Ganapathi, TR., et al. 2007. Plant Cell Rep. 26: 1575-84. PMID: 17534624
- Isolement des anneaux d'actomyosine cytocinétiques de Saccharomyces cerevisiae et Schizosaccharomyces pombe. | Huang, J., et al. 2016. Methods Mol Biol. 1369: 125-136. PMID: 26519310
- Inhibition des activités protéolytiques des cellules végétales qui dégradent la tubuline. | Morejohn, LC., et al. 1985. Cell Biol Int Rep. 9: 849-57. PMID: 2864138
- Préparation de vésicules recouvertes de clathrine à partir de plantules d'Arabidopsis thaliana. | Mosesso, N., et al. 2018. Front Plant Sci. 9: 1972. PMID: 30687367
- Les leupeptines, nouveaux inhibiteurs de protéase provenant d'actinomycètes. | Aoyagi, T., et al. 1969. J Antibiot (Tokyo). 22: 283-6. PMID: 5810993
- Polymérisation des microtubules roses induite par le taxol in vitro et son inhibition par la colchicine. | Morejohn, LC. and Fosket, DE. 1984. J Cell Biol. 99: 141-7. PMID: 6145718
- La cathepsine B, la cathepsine H et la cathepsine L. | Barrett, AJ. and Kirschke, H. 1981. Methods Enzymol. 80 Pt C: 535-61. PMID: 7043200
- Cathepsine B humaine. Application du substrat N-benzyloxycarbonyl-L-arginyl-L-arginine 2-naphthylamide à une étude de l'inhibition par la leupeptine. | Knight, CG. 1980. Biochem J. 189: 447-53. PMID: 7213339
Informations pour la commande
| Nom du produit | Ref. Catalogue | COND. | Prix HT | QTÉ | Favoris | |
Leupeptin hemisulfate, 5 mg | sc-295358 | 5 mg | RMB824.00 | |||
Leupeptin hemisulfate, 10 mg | sc-295358C | 10 mg | RMB1139.00 | |||
Leupeptin hemisulfate, 25 mg | sc-295358A | 25 mg | RMB1670.00 | |||
Leupeptin hemisulfate, 50 mg | sc-295358D | 50 mg | RMB3565.00 | |||
Leupeptin hemisulfate, 100 mg | sc-295358E | 100 mg | RMB5630.00 | |||
Leupeptin hemisulfate, 500 mg | sc-295358B | 500 mg | RMB16099.00 |
