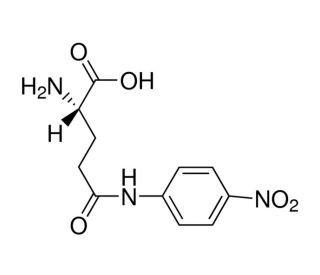
L-Glutamic acid γ-(4-nitroanilide) (CAS 7300-59-6)
ACCÈS RAPIDE AUX LIENS
L'acide L-Glutamique γ-(4-nitroanilide) est un composé qui sert de substrat à l'enzyme γ-glutamyltransférase (GGT) dans divers essais biochimiques. Lorsqu'il est utilisé dans des applications expérimentales, l'acide L-Glutamique γ-(4-nitroanilide) sert de substrat spécifique pour la GGT, ce qui permet de mesurer l'activité de la GGT dans des échantillons biologiques. Lors de l'interaction avec la GGT, l'acide L-Glutamique γ-(4-nitroanilide) subit un clivage enzymatique, ce qui entraîne la libération de 4-nitroaniline. Cette réaction peut être mesurée quantitativement à l'aide de méthodes spectrophotométriques, ce qui permet de connaître les niveaux d'activité de la GGT dans les systèmes biologiques. Le mécanisme d'action de l'acide L-glutamique γ-(4-nitroanilide) implique sa reconnaissance spécifique et son clivage par l'enzyme GGT, conduisant à la génération d'un produit mesurable.
L-Glutamic acid γ-(4-nitroanilide) (CAS 7300-59-6) Références
- Relation non linéaire de l'énergie libre dans l'acylation catalysée par un acide général de la gamma-glutamyl transpeptidase du rein de rat par une série d'analogues du substrat gamma-glutamyl anilide. | Ménard, A., et al. 2001. Biochemistry. 40: 12678-85. PMID: 11601992
- La caractérisation de la gamma-glutamyltranspeptidase d'Helicobacter pylori révèle la base moléculaire de la spécificité du substrat et un rôle critique de la boucle contenant la tyrosine 433 dans la catalyse. | Morrow, AL., et al. 2007. Biochemistry. 46: 13407-14. PMID: 17960917
- La structure cristalline de la gamma-glutamyltranspeptidase inhibée par l'acivicine révèle le rôle critique de son extrémité C-terminale dans l'autotraitement et la catalyse. | Williams, K., et al. 2009. Biochemistry. 48: 2459-67. PMID: 19256527
- Propriétés biochimiques et structurales de la gamma-glutamyl transpeptidase de Geobacillus thermodenitrificans: une enzyme spécialisée dans l'activité hydrolase. | Castellano, I., et al. 2010. Biochimie. 92: 464-74. PMID: 20138205
- Clonage des gènes et expression des protéines des γ-glutamyltranspeptidases de Thermus thermophilus et Deinococcus radiodurans: comparaison des propriétés moléculaires et structurelles avec les homologues mésophiles. | Castellano, I., et al. 2011. Extremophiles. 15: 259-70. PMID: 21298394
- Caractérisation de MtfA, une nouvelle protéine de signal de sortie réglementaire du système de glucose-phosphotransférase chez Escherichia coli K-12. | Göhler, AK., et al. 2012. J Bacteriol. 194: 1024-35. PMID: 22178967
- γ-Glutamyltranspeptidases: séquence, structure, propriétés biochimiques et applications biotechnologiques. | Castellano, I. and Merlino, A. 2012. Cell Mol Life Sci. 69: 3381-94. PMID: 22527720
- Spécificité du substrat donneur de la gamma-glutamyltransférase du rein bovin. | Agblor, AA. and Josephy, PD. 2013. Chem Biol Interact. 203: 480-5. PMID: 23500672
- Purification partielle et propriétés de la gamma-glutamyltranspeptidase des mycéliums de Morchella esculenta. | Moriguchi, M., et al. 1986. Arch Microbiol. 144: 15-9. PMID: 2870692
- Comportement du L-gamma-glutamyl-4-nitroanilide et du L-gamma-glutamyl-3-carboxy-4-nitroanilide vis-à-vis de gamma-glutamyltransférases d'origines différentes. | Verhoeff, PM., et al. 1988. Clin Chim Acta. 175: 129-34. PMID: 2900705
- Distribution et caractérisation de la fonction du lysozyme de type i d'Apostichopus japonicus. | Li, C., et al. 2018. Fish Shellfish Immunol. 74: 419-425. PMID: 29079205
- Une bio-encre photoréticulable dérivée de la MEC rénale accélère la formation de tissus rénaux. | Ali, M., et al. 2019. Adv Healthc Mater. 8: e1800992. PMID: 30725520
- Biodistribution du cuivre après administration systémique aiguë de gluconate de cuivre à des rats. | García-Martínez, BA., et al. 2021. Biometals. 34: 687-700. PMID: 33900531
- Tridegin, un nouvel inhibiteur peptidique du facteur XIIIa, provenant de la sangsue Haementeria ghilianii. | Finney, S., et al. 1997. Biochem J. 324 (Pt 3): 797-805. PMID: 9210403
- Analyse des propriétés cinétiques de la gamma-glutamyl transpeptidase du rein de rat. | Dvoráková, L., et al. 1996. Gen Physiol Biophys. 15: 403-13. PMID: 9228521
Informations pour la commande
| Nom du produit | Ref. Catalogue | COND. | Prix HT | QTÉ | Favoris | |
L-Glutamic acid γ-(4-nitroanilide), 1 g | sc-250219 | 1 g | CNY542.00 |
