CRISPR系统
圣克鲁斯生物技术公司现在为超过 18,910 个人类蛋白质编码基因和 18,340 个小鼠蛋白质编码基因提供靶向特异性 CRISPR/Cas9 基因敲除 (KO) 质粒、CRISPR 双尼克酶质粒、CRISPR/ dCas9 激活质粒和 CRISPR Lenti 激活系统。
CRISPR/Cas9背景
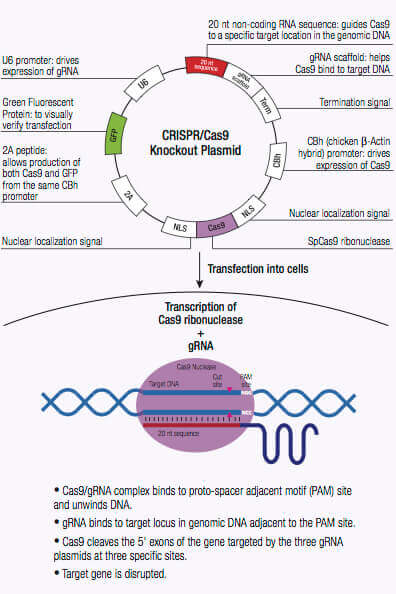
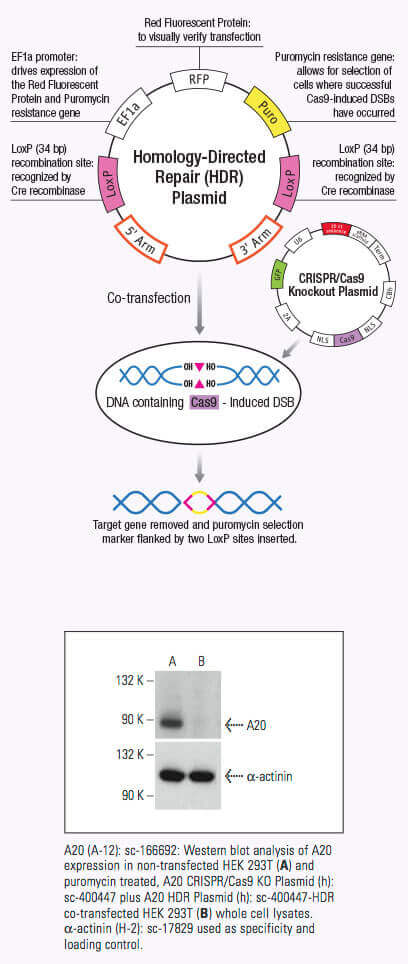
CRISPR/ CAS系统是一种细菌和古细菌用于外源遗传物质的降解的适应性免疫防御机制。在这些生物体中,来自噬菌体的外源遗传物质获得和整合入CRISPR位点 (1,2)。这种新材料,也称为间隔区,建立用于将来对噬菌体感染性的序列特异性的片段。这些序列特异性的片段 被翻 译成短CRISPR的RNA(crRNAs),其功能为经由CRISPR相关(Cas)蛋白的核酸酶活性,由CRISPR位点编码导向,互补侵入 DNA裂解(1,2)。 II型CRISPR系统Cas9核酸酶具有RNA结合域,α螺旋识别叶(REC),核酸叶,其中包括RuvC和HNH的DNA裂解和 前间区序列邻近基序(PAM)交叉位点(1 ,2)。 crRNA形成与Cas9核酸酶的复合通过结合到REC叶内桥螺旋,并形成多个具有crRNA骨干的盐桥 (1,2,3)。
一旦crRNA结合到Cas9,Cas9核酸酶的构象发生改变,产生一条能通道,让DNA更容易结合。Cas9/crRNA复合体扫描DNA找到PAM (5'-NGG)位点(4,5,6)。识别PAM位点导致DNA解旋,使crRNA找到PAM位点相邻的DNA互补链。当Cas9结合到PAM位点相邻的,与crRNA互补的DNA序列上,REC叶内部的桥螺旋和靶DNA形成RNA-DNA 异源双链结构。PAM位点的识别包括可使靶DNA双链断裂(DSB)的HNH和RuvC核断裂的激活,和导致DNA降解(1,2,5,8)。如果crRNA与靶DNA不互补,Cas9将会释放出来,寻找新的PAM位点(7)。DNA中的线性靶基因组断裂后可以通过非同源末端接合(NHEJ)或者同源介导的修复(HDR)来进行修复。非同源末端接合(NHEJ)会引起插入或者删除错误。同源介导的修复(HDR)可在基因组(2,9,10)的特异性位点结合特定标记。CRISPR/Cas9机制可用于包括哺乳动物细胞在内的各种系统的基因工程中。
采用DSBs进行基因编辑,可以用大范围核酸酶,锌指核酸酶(ZF),或者反式激活因子样的感受器(TALEs)进行,它们可以识别DNA序列,然而,每种方法都有它们的局限性。当使用大范围核酸酶时,难以清楚的显示核酸酶和DNA之间的位点专一识别 (2)。其他选项,ZFs和TALEs,已证明难以设计和识别DNA的3个核苷酸。作用像crRNAs的单个导向RNAs (sgRNAs) 容易设计,还能和Cas9核酸酶在同一载体中一起表达,针对特定DNA位点进行基因编辑。当用于筛选时, CRISPR/Cas 9系统比短发卡RNAs具有更高的敏感性和更高的效率。
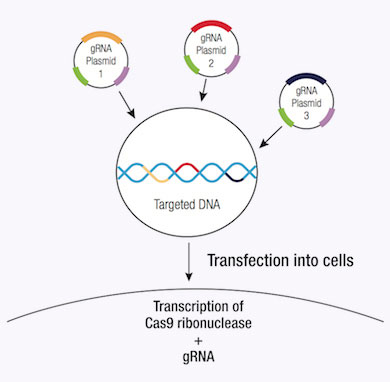
使用CRISPR/Cas9系统来减少DSB在基因组DNA的一个重要优势是它的高效。然而这个效率能被一些脱靶效应影响,因此减少CRISPR/Cas9编辑的特异性。特异性能通过使用CRISPR双切口酶系统完善,凭借一对质粒,每一个编码Cas9 (D10A)切口酶突变体(Cas9n)都是通过利用特异的向导RNA来针对明显的基因组DNA特定区域(12)。每个Cas9n/sgRNA复合体仅创造了一个DNA链缺口,是用来让向导RNA补充进来(12)。每对向导RNA被近20个碱基对抵消,并且识别出靶向DNA反义链上的目标序列。一对Cas9n/sgRNA复合体制造了类似于DSB (12)的双切口。因此,成对向导RNA的使用需要考虑到Cas9-调停基因编辑的特异性的增加,同时保持高水平的效率(12)。
除基因组编辑技术之外,CRISPR系统可以被改造成内源基因表达上调的系统(13)。通过修饰CRISPR系统中的一些元件,形成协同激活介质(SAM)复合物,成为一种高效特异地转录激活系统 (13)。SAM复合物中的一个元件是修饰过的Cas9核酸酶。SAM系统中,灭活Cas9的催化域形成dCas9后与转录激活域 (vp64)进行融合。经靶特异向导RNA (sgRNA)引导,dCas9-VP64-sgRNA复合物靶向内源基因转录起始位点(Transcriptional Start Site (TSS))的-200bp处,上调基因表达(13)。为了进一步提高转录效率,在sgRNA四环和第二个茎环上附加小发夹适配子(minimal hairpin aptamer) 方式修饰sgRNA(13)。经过修饰后,sgRNA上的适配体选择性地与二聚体的MS2噬菌体外壳蛋白结合(13)。 MS2蛋白与p65及HSF1转录激活域融合后形成MS2-P65-HSF1融合蛋白增强转录因子的招募,从而提高dCas9介导的基因活化效率(13)。 激活产品有两种形式,一种是用于转染的标准质粒,还有一种是用于慢病毒包装和转导的慢病毒质粒,它可以高效地将SAM转录激活系统递送到所有的细胞(13)。
CRISPR/Cas9-定向双链断裂 (DSB)