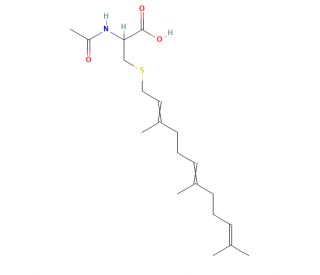
N-Acetyl-S-farnesyl-L-cysteine (AFC) (CAS 135304-07-3)
ENLACES RÁPIDOS
N-Acetyl-S-farnesyl-L-cysteine (AFC) es una cisteína derivatizada sintéticamente que inhibe las enzimas S-farnesilcisteína carboxil metiltransferasas. Estas enzimas reconocen a AFC como un sustrato a través del grupo farnesilo, y la ocupación del sitio de unión bloquea el procesamiento de proteínas farnesiladas por la enzima. La metilación carboxílica de proteínas farnesiladas es una modificación importante que regula la función de la proteína. El bloqueo del procesamiento de metiltransferasa de proteínas rap1 de plaquetas por AFC conduce a la inhibición de la agregación de plaquetas. AFC también bloquea el movimiento celular y la adhesión de la membrana de las proteínas Ras, interfiriendo con el procesamiento de metilación carboxílica. N-Acetyl-S-farnesyl-L-cysteine como sustrato para la metiltransferasa de proteínas isopreniladas, bloquea la liberación de radical anión superóxido estimulada por fMet-Leu-Phe en células neutrófilas. La inhibición de la quimiotaxis de neutrófilos por AFC también produce supresión de la respuesta inflamatoria inducida por 12-O-tereadecanoyl-phorbol-13-acetate y arachidonic acid.
N-Acetyl-S-farnesyl-L-cysteine (AFC) (CAS 135304-07-3) Referencias
- La metilación carboxílica de Ras regula la orientación a la membrana y la participación de efectores. | Chiu, VK., et al. 2004. J Biol Chem. 279: 7346-52. PMID: 14660603
- Estimulación de la actividad de Rac1 por el factor de necrosis tumoral alfa. Papel de la isoprenilcisteína carboxilmetiltransferasa. | Papaharalambus, C., et al. 2005. J Biol Chem. 280: 18790-6. PMID: 15647276
- Mecanismo cinético de la proteína isoprenilada metiltransferasa. | Shi, YQ. and Rando, RR. 1992. J Biol Chem. 267: 9547-51. PMID: 1577795
- Análogos de la farnesilcisteína sustituidos por amidas como inhibidores de la isoprenilcisteína carboxil metiltransferasa humana. | Donelson, JL., et al. 2006. Bioorg Med Chem Lett. 16: 4420-3. PMID: 16777414
- La N-acetil-S-farnesil-L-cisteína tópica inhibe la inflamación de la piel del ratón y, a diferencia de la dexametasona, sus efectos se limitan al lugar de aplicación. | Gordon, JS., et al. 2008. J Invest Dermatol. 128: 643-54. PMID: 17882268
- La carboximetilación de las proteínas rap1 plaquetarias es estimulada por la guanosina 5'-(3-O-thio)trifosfato. | Huzoor-Akbar, ., et al. 1991. J Biol Chem. 266: 4387-91. PMID: 1900293
- Reacciones de metilación y desmetilación de las proteínas de unión a nucleótidos de guanina de los segmentos externos de los bastones de la retina. | Pérez-Sala, D., et al. 1991. Proc Natl Acad Sci U S A. 88: 3043-6. PMID: 1901651
- Identificación de la unidad de reconocimiento para la metilación de proteínas G. | Tan, EW., et al. 1991. J Biol Chem. 266: 10719-22. PMID: 1904056
- Efectos de los análogos de la farnesilcisteína sobre la carboximetilación de proteínas y la transducción de señales. | Volker, C., et al. 1991. J Biol Chem. 266: 21515-22. PMID: 1939182
- Análogos de la prenilcisteína sustituidos por lípidos y azufre como inhibidores de la Icmt humana. | Bergman, JA., et al. 2011. Bioorg Med Chem Lett. 21: 5616-9. PMID: 21782433
- La N-acetil-S-farnesil-l-cisteína suprime la producción de quimioquinas por las células endoteliales microvasculares dérmicas humanas. | Adhami, K., et al. 2012. Exp Dermatol. 21: 700-5. PMID: 22897577
- Estudios mecanísticos sobre la proteína isoprenilada metiltransferasa de las plaquetas humanas: los análogos de la farnesilcisteína bloquean la agregación plaquetaria sin inhibir la metiltransferasa. | Ma, YT., et al. 1994. Biochemistry. 33: 5414-20. PMID: 8180165
- Los análogos de la farnesil-L-cisteína pueden inhibir o iniciar la liberación de superóxido por los neutrófilos humanos. | Ding, J., et al. 1994. J Biol Chem. 269: 16837-44. PMID: 8207006
- Un análogo de la proteína prenilcisteína inhibe la transducción de señales mediada por agonista-receptor en plaquetas humanas. | Huzoor-Akbar, ., et al. 1993. Proc Natl Acad Sci U S A. 90: 868-72. PMID: 8430099
- Metilación carboxílica de proteínas relacionadas con Ras durante la transducción de señales en neutrófilos. | Philips, MR., et al. 1993. Science. 259: 977-80. PMID: 8438158
Información sobre pedidos
| Nombre del producto | Número de catálogo | UNIDAD | Precio | CANTIDAD | Favoritos | |
N-Acetyl-S-farnesyl-L-cysteine (AFC), 5 mg | sc-200839 | 5 mg | RMB970.00 | |||
N-Acetyl-S-farnesyl-L-cysteine (AFC), 25 mg | sc-200839A | 25 mg | RMB2538.00 |
